
Científics de l’IRB Barcelona revelen la influència de les mitocòndries en l’autofàgia
Un estudi liderat per investigadors de l’Institut de Recerca Biomèdica (IRB Barcelona), ubicats al Parc Científic de Barcelona, descobreix com els mitocondris impulsen l’autofàgia mitjançant l’edició genètica amb CRISPR-Cas9. La investigació, publicada en la revista Autophagy, obre la porta a desenvolupar teràpies que regulin l’autofàgia en malalties metabòliques i promoure un envelliment saludable.
L’equip liderat pel Dr. Antonio Zorzano i la Dra. Saska Ivanova al grup Malalties Metabòliques Complexes i Mitocondris de l’IRB Barcelona aporta nous coneixements sobre les connexions entre les proteïnes mitocondrials MFN1 i MFN2 i el procés d’autofàgia. Aquest avenç aprofundeix en com les cèl·lules reciclen els seus components per mantenir un metabolisme òptim, alhora que ofereix pistes sobre possibles estratègies per combatre l’envelliment cel·lular i malalties relacionades amb alteracions metabòliques.
L’autofàgia és el mecanisme pel qual les cèl·lules digereixen i renoven les seves estructures internes, reciclant proteïnes i orgànuls danyats o que ja no funcionen com haurien de fer-ho. En reutilitzar aquestes molècules bàsiques, les cèl·lules obtenen l’energia i els recursos necessaris per mantenir-ne l’equilibri. Tot i això, quan l’autofàgia s’altera, es produeixen alteracions associades a l’envelliment, la pèrdua de massa muscular (sarcopènia) o diferents malalties metabòliques, com l’obesitat o la diabetis. En aquest context, restaurar el bon funcionament de l’autofàgia es podria convertir en una via prometedora per millorar la salut.
“El fet que aquestes proteïnes mitocondrials controlin processos de reciclatge tan crucials ens ajuda a entendre per què en modificar-les poden aparèixer la sarcopènia i altres problemes associats a l’edat”, explica el Dr. Zorzano, que també és Catedràtic de la Facultat de Biologia de la UB i membre del CIBERDEM. “Si aconseguim dissenyar molècules que regulin aquestes interaccions, podríem prevenir o revertir alteracions cel·lulars relacionades amb l’envelliment i les malalties metabòliques”.
L’edició genètica amb CRISPR-Cas9
Un aspecte innovador d’aquest treball és la metodologia utilitzada: l’equip va recórrer a l’edició genètica amb CRISPR-Cas9 per marcar les proteïnes MFN1 i MFN2 a la mateixa cèl·lula, sense recórrer a la sobreexpressió artificial. D’aquesta manera, l’equip va poder estudiar les mitofusines en condicions molt semblants a les que es donen de manera natural. “Marquem aquestes proteïnes sense alterar-les ni produir-les en excés, cosa que ens va permetre apropar-nos a la seva funció real en el reciclatge cel·lular”, explica la Dra. Isabel Gordaliza-Alaguero, primera autora de l’article.
Gràcies a aquesta estratègia, es van obtenir dades més precises sobre com varien les interaccions de MFN1 i MFN2 en resposta a diferents condicions nutricionals, incloses situacions de carència extrema de nutrients. Això ajuda a comprendre millor els mecanismes que regulen l’equilibri energètic a la cèl·lula, un dels pilars del metabolisme saludable.
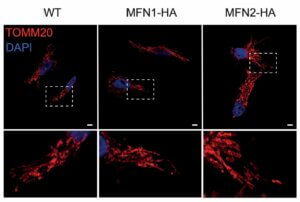
Gràcies a l’edició genètica amb CRISPR-Cas9, l’equip ha pogut estudiar aquestes proteïnes sense alterar-les ni produir-les en excés, aconseguint així observar-ne la funció real. Imatge/ IRB Barcelona
Implicacions i línies de futur
Aquests descobriments, a més d’aprofundir en la comprensió del metabolisme cel·lular, obren la porta a possibles aplicacions terapèutiques. Regular l’autofàgia mitjançant fàrmacs o compostos específics podria tenir implicacions en el tractament de malalties metabòliques com l’obesitat i la diabetis tipus 2, que estan vinculades a problemes en la producció i degradació de lípids i proteïnes. A més, té el potencial de frenar l’envelliment cel·lular perquè un funcionament millor de l’autofàgia pot contribuir a mantenir la qualitat dels orgànuls i prevenir la sarcopènia i altres malalties associades a l’edat.
“El següent pas serà investigar quines regions concretes de les mitofusines resulten essencials per a aquestes noves interaccions, per tal de dissenyar molècules que imitin o bloquegin aquestes unions quan sigui necessari”, afegeix la Dra. Ivanova. L’equip també preveu estudiar en models animals com influeix el control de l’autofàgia a l’estat energètic de les cèl·lules a llarg termini.
Aquest treball s’ha dut a terme en col·laboració amb els laboratoris liderats per la Dra. Maria Macias (IRB Barcelona i ICREA) i el Dr. Manuel Palacín (IRB Barcelona, UB i CIBERER), i ha rebut finançament de fons FEDER i Horizon 2020 de la Comunitat Europea, la Fundació BBVA, la Fundació Marató de TV3 i la Fundació ”la Caixa”.
» Article de referència: Gordaliza-Alaguero, I., Sànchez-Fernàndez-de-Landa, P., Radivojevikj, D., Villarreal, L., Arauz-Garofalo, G., Gay, M., … Zorzano, A. (2024). Endogenous interactomes of MFN1 and MFN2 provide novel insights into interorganelle communication and autophagy. Autophagy, 1–22. doi: 10.1080/15548627.2024.2440843
» Enllaç a la notícia: web de l’IRB [+]




