Investigadores del IRB Barcelona descubren un interruptor molecular que regula la puerta de entrada de los aminoácidos en la célula
Científicos del IRB Barcelona, ubicado en el Parque Científico de Barcelona, revelan cómo una lisina actúa como mecanismo de control para abrir y cerrar la compuerta interior de un transportador de aminoácidos. Un nuevo estudio publicado en la revista PNAS Nexus y liderado por los investigadores del IRB Barcelona la Dra. Joana Fort y el Prof. Manuel Palacín, en colaboración con el grupo del Prof. Thorben Cordes, de la Universidad de Múnich (LMU) y la participación de los grupos del Prof. Modesto Orozco (IRB Barcelona) y del Dr. Óscar Llorca (CNIO) ha aportado nueva información sobre el mecanismo de estos transportadores de aminoácidos.
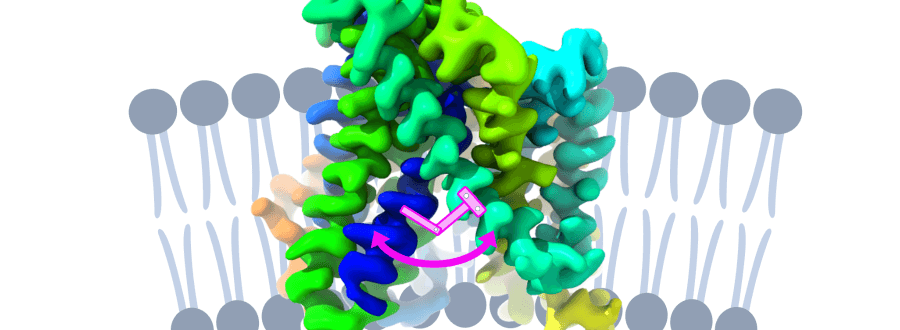
Los transportadores de aminoácidos LATs son proteínas esenciales para el metabolismo celular y están implicados en diversas enfermedades raras y alteraciones metabólicas. En concreto, la investigación muestra cómo un aminoácido llamado lisina, presente en una región concreta de la proteína (la hélice transmembrana 5), funciona como un muelle que regula la apertura y el cierre de la puerta interna de estos transportadores, asegurando el control del paso de aminoácidos a través de la membrana celular, de manera similar al muelle de la puerta.
Mediante un enfoque multidisciplinar que combina criomicroscopía electrónica (cryoEM), transmisión de energía de resonancia por fluorescencia de una molécula individual (smFRET) y simulaciones de dinámica molecular, el equipo ha caracterizado la interacción clave entre la lisina conservada en la hélice transmembrana 5 del transportador BasC. En concreto, han visto que la lisina estabiliza los cambios conformacionales necesarios para que la proteína lleve a cabo el intercambio de aminoácidos, un proceso esencial para numerosas funciones celulares.
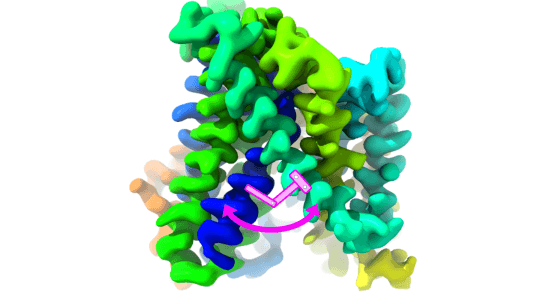
Estructura de la proteína de membrana BasC resuelta por cryoEM. Se muestra un esquema que representa la estructura del transportador, destacando en rosa la lisina clave que actúa como un muelle en el mecanismo de apertura y cierre de la puerta interior.
“Gracias a la combinación de técnicas experimentales de vanguardia, hemos podido observar y cuantificar de forma precisa estos movimientos moleculares,” añade la Dra. Fort, investigadora del IRB Barcelona y del CIBERER y co-primera autora y coautora de correspondencia del trabajo. Este estudio es el resultado del trabajo conjunto con el Dr. Adrià Nicolàs y con otros investigadores del IRB Barcelona, de la LMU y el CNIO, cuyo esfuerzo ha sido clave para desentrañar el papel de la lisina en la regulación de la compuerta interna de los transportadores LAT.
“Nuestros resultados muestran cómo esta lisina desempeña un papel esencial en la regulación de la compuerta interna de estos transportadores, abriendo nuevas posibilidades para comprender mejor su función de transporte de aminoácidos y su relación con diversas patologías”, explica el Prof. Palacín, jefe del laboratorio de Transportadores de Aminoácidos y Enfermedades del IRB Barcelona y catedrático del Departamento de Bioquímica y Biomedicina Molecular de la Facultad de Biología de la UB y jefe de grupo del CIBERER. “Cabe destacar que esta lisina se encuentra mutada en pacientes humanos con Lysinuric Protein Intolerance (LPI) en el transportador y+LAT1, lo que refuerza su papel clave en la función de estos transportadores.”
Este hallazgo aporta nuevas pistas para el posible desarrollo de estrategias terapéuticas dirigidas a modular la actividad de los transportadores de aminoácidos, con potenciales aplicaciones en patologías como afecciones metabólicas, enfermedades minoritarias y el cáncer.
» Artículo de referencia: The conserved lysine residue in transmembrane helix 5 is pivotal for the cytoplasmic gating of the L-amino acid transporters. Joana Fort, Adrià Nicolàs-Aragó, Luca Maggi, Maria Martinez-Molledo, Despoina Kapiki, Paula González-Novoa, Patricia Gómez-Gejo, Niels Zijlstra, Susanna Bodoy, Els Pardon, Jan Steyaert, Oscar Llorca, Modesto Orozco, Thorben Cordes, Manuel Palacín. PNAS nexus (2025) doi: 10.1093/pnasnexus/pgae584
» Enlace a la noticia: web del IRB [+]




